의료기기 GMP / GMP / 의료기기 / ISO인증/밸리데이션/제조 및 품질관리기준/의료기기 적합성 인정 등 심사기준/생산 및 서비스 제공/제품실현-6

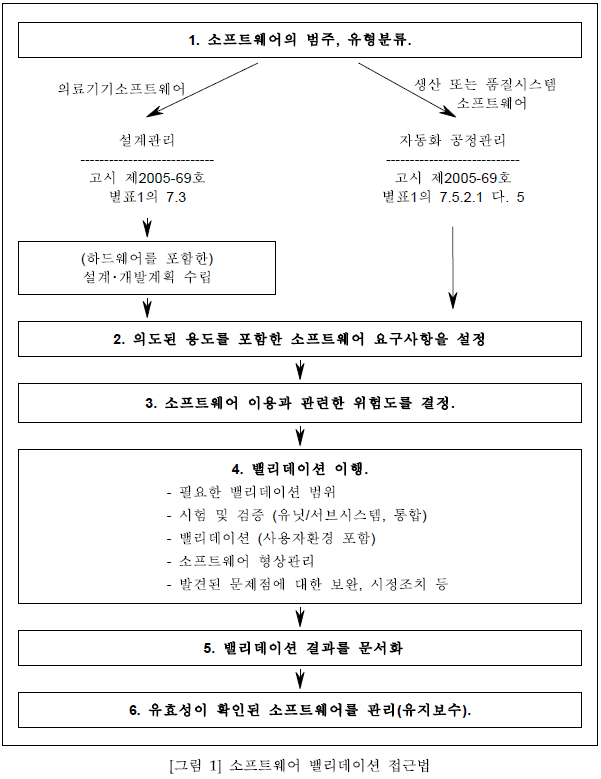
안녕하세요. 이지 솔 텍요^^오늘은 의료 기기의 생산 및 서비스 제공에 대해서 말씀 드리겠습니다.멸균 의료 기기에 대한 특별 요구 사항 ☞ 조직은 각 멸균 배치에 사용된 멸균 공정의 파라미터(parameter)의 기록을 유지할 필요가 있습니다.멸균 기록은 의료 기기의 각 생산 배치까지 추적할 수 있을 필요가 있습니다.생산 및 서비스 제공 프로세스의 유효성 확인(Validation)☞ 조직은 결과적으로 나타난 출력이 후속 모니터링 또는 측정에 의해서 검증할 수 없는 모든 생산 및 서비스 제공 프로세스에 대해서 유효성을 확인해야 합니다.유효성 확인에는 제품 사용 또는 서비스의 인도 후에만 차이가 나타나는 모든 과정이 포함됩니다.☞ 유효성 확인은 계획된 결과를 일관하고 달성하기 위한 프로세스의 능력을 증명할 필요가 있습니다.☞ 조직은 다음을 포함한 프로세스의 유효성 확인 절차를 문서화할 필요가 있습니다.1. 프로세스의 검토 및 승인을 위한 규정된 기준 2. 기기 및 인원의 적격성 3. 특정 방법, 절차 및 합격 기준의 사용 4. 해당하는 경우, 샘플 사이즈에 관한 근거를 포함한 통계적 수법 5. 기록에 대한 요구 사항 6. 유효성 다시 확인 기준을 포함한 유효성 재확인(revalidation)7. 프로세스에 변경 승인 ☞ 조직은 생산 및 서비스 제공에 사용되는 컴퓨터 소프트웨어의 적용에 대한 유효성 확인을 문서화할 필요가 있습니다.이들의 소프트웨어의 적용은 최초의 사용 전에 유효성이 확인돼야 하고, 해당하는 경우는 그런 소프트웨어의 변경 또는 적용 후에도 유효성이 확인되어야 한다.소프트웨어의 유효성 확인 및 유효성의 재확인에 관련한 구체적인 접근과 활동은 제품의 사양에 맞도록 제품의 성능에 미치는 영향을 포함한 소프트웨어의 사용에 관련된 리스크에 비례해야 한다.☞ 유효성 확인 결과와 결론, 그리고 유효성 확인에 의하여 필요한 조치의 기록은 유지되어야 한다.멸균 및 멸균 포장 프로세스의 유효성 확인에 관한 특별 요구 사항 ☞ 조직은 멸균 및 멸균 보호 시스템에 대한 프로세스의 유효성 확인을 위한 절차를 문서화할 필요가 있습니다.☞ 멸균 및 멸균 보호 시스템에 대한 프로세스는 최초 사용 전에, 그리고 해당하는 경우는, 제품 또는 프로세스 변경 전에 유효성을 확인할 필요가 있습니다.☞ 유효성 확인 결과와 결론, 그리고 유효성 확인에 따른 필요한 조치의 기록은 유지되어야 합니다.감사합니다。지금까지 의료 기기의 생산 및 서비스 제공에 대해서 알아봤습니다.출처:식품 의약품 안전처 ▽ ▽ ▽ ▽ ▽ ▽ ▽ ▽

저희 이지솔텍은 식약처가 필요로 하는 부분을 컨설팅하는 전문기업입니다.인증·컨설팅·교육에 대해 궁금한 점이 있으시면, 아래의 전화나 홈페이지로 견적 의뢰해 주십시오.친절하고 자세하게 설명해드릴게요. GMP 인증 컨설팅 문의 02)403.6258htp://www.egsolutech.com

http://www.egsolutech.com/
(주)이지솔텍이지솔텍,GMP인증,의약품,의료기기,화장품,건강기능식품,ISO인증컨설팅전문기업 www.egsolutech.com#gmp #cgmp #화장품gmp #gmp인증 #cgmp화장품 #ISO22716 #ISO #기능성화장품#ISO인증#GMP교육#의약품gmp#의료기기gmp#ISO13485#건강기능식품gmp#HACCP#식품의약품안전처[이지솔텍]EGSolutech[기능성화장품 gMP]기능성화장품[ISO]GMP #의약품 #의료기기 #적격성평가 #Autoclave #cleanbench #cellave #cell

